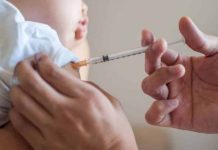
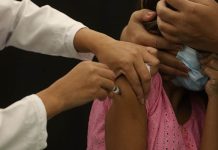
Os testes em humanos irão verificar a segurança e a eficácia do soro contra a covid-19.
Leia mais:
De acordo com o Butantan, há três mil frascos prontos para serem testados em humanos. A previsão é de que eles comecem a ser aplicados a partir das próximas semanas. Será a primeira vez em que humanos receberão esse soro.
O material não é para a prevenção da doença. O objetivo do soro, conforme o Butantan, é atuar no tratamento da enfermidade e evitar que o paciente desenvolva quadro grave.
O primeiro passo para a obtenção do soro foi isolar o novo coronavírus em materiais coletados de um paciente brasileiro infectado. Depois, esse vírus foi cultivado em laboratório, inativado por radiação — com apoio do Instituto de Pesquisas Energéticas e Nucleares (IPEN) — e submetido a vários testes em camundongos, para assegurar que não traria riscos.
O vírus inativado foi aplicado em cavalos. Após receberem o material, esses animais produziram anticorpos. Depois, o plasma resultante (a porção líquida do sangue que contém fatores de coagulação, anticorpos e outras proteínas) foi coletado e processado pelo Butantan. A partir de então, surgiu o soro.
Na fase pré-clínica, pesquisadores do Butantan fizeram um “teste de desafio” em parceria com a Universidade de São Paulo (USP). Nele, camundongos e coelhos foram infectados pelo novo coronavírus e receberam o soro. Segundo o Instituto, houve diminuição da carga viral desses animais, além de preservação da estrutura pulmonar deles.
Desde março, o Instituto Butantan tenta a aprovação do soro para testes em humanos. Na época, a Anvisa avaliou o pedido e deu anuência para a pesquisa em brasileiros, mas depois pediu mais informações, o que fez com que os estudos clínicos fossem adiados.
Na semana passada, o diretor do Instituto, Dimas Covas, disse que a demora da Anvisa, vinculada ao Ministério da Saúde, representava insegurança da agência, que, segundo ele, sempre se pronuncia após outras entidades internacionais.
“Quando se submete à Anvisa pela primeira vez um soro, existe uma dificuldade lá, uma insegurança. Porque essa decisão vai valer pro mundo inteiro”, declarou, durante reunião pública virtual na Assembleia Legislativa de São Paulo.
A Anvisa avaliou a proposta de pesquisa integralmente, sem apoio de agências estrangeiras, porque as fases iniciais são feitas somente no Brasil. A agência argumenta que, por se tratar da primeira vez que o material seria testado em pessoas, precisou fazer uma “avaliação criteriosa dos aspectos técnicos e de segurança do produto”.

























… [Trackback]
[…] Info on that Topic: msnamidia.com.br/2021/05/25/covid-19/entenda-melhor-o-que-e-o-soro-anti-covid-desenvolvido-e-testado-pelo-butantan/ […]
… [Trackback]
[…] Find More on that Topic: msnamidia.com.br/2021/05/25/covid-19/entenda-melhor-o-que-e-o-soro-anti-covid-desenvolvido-e-testado-pelo-butantan/ […]
… [Trackback]
[…] Read More here to that Topic: msnamidia.com.br/2021/05/25/covid-19/entenda-melhor-o-que-e-o-soro-anti-covid-desenvolvido-e-testado-pelo-butantan/ […]
… [Trackback]
[…] Find More Information here to that Topic: msnamidia.com.br/2021/05/25/covid-19/entenda-melhor-o-que-e-o-soro-anti-covid-desenvolvido-e-testado-pelo-butantan/ […]
… [Trackback]
[…] Information to that Topic: msnamidia.com.br/2021/05/25/covid-19/entenda-melhor-o-que-e-o-soro-anti-covid-desenvolvido-e-testado-pelo-butantan/ […]